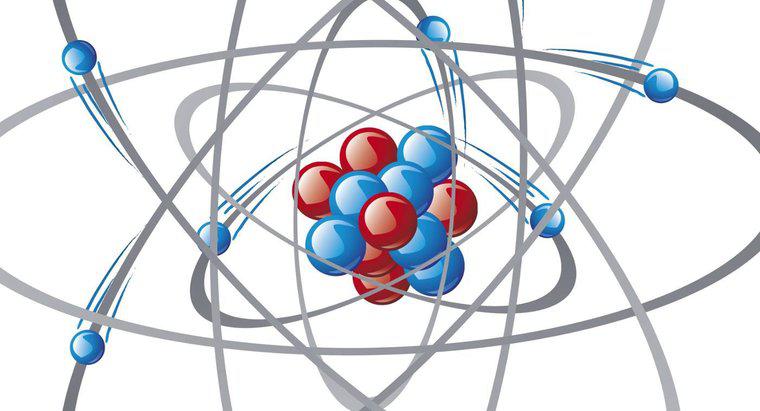
Bir atom elektronları kaybettiğinde bir katyon oluşur. Elektronları kaybeden bir atom negatif yükünü kaybeder; bu nedenle, pozitif olarak yüklenir. Bu atomlar elektronlar için düşük bir afiniteye veya çekiciliğe sahiptir ve elektropozitif atomlar olarak adlandırılır.
Oktet kuralına göre, atomlar en dış enerji seviyelerinde sekiz elektron elde etmek için elektronlar kazanmaya veya kaybetmeye çalışırlar; bu, bu enerji kabuklarında ve atomun en kararlı formunda izin verilen maksimum elektron sayısıdır. Periyodik tablodaki en fazla elektron sayısına sahip olan ve en dış enerji seviyelerinde bulunan elementler asil gazlardır. Bu elementler tüm elementlerin en stabil olanıdır ve diğerleri ile bileşikler oluşturmakta isteksizdirler. Diğer tüm elementler, soy gazları elektron konfigürasyonu açısından taklit etmek istemektedir.
Dış enerji seviyelerinde çok az elektron bulunan atomlar, elektronları diğer atomlara kaybetme eğilimindedir. Katyon olma olasılığı en fazla olan elementler, periyodik tablonun alkali metal ve toprak alkali metal gruplarına aittir, çünkü bunlar en elektropozitif elementlerdir.
Katyonlarla kaybolan elektronlar, periyodik tablonun sağ tarafında bulunan kuvvetli elektronegatif elementler tarafından toplanır. Elektronları daha kararlı hale getirmek için toplayan atomlara anyon denir. Karşıt yükler çektiğinden, katyonlar ve anyonlar tipik olarak bağlar oluşturur ve böylece nötr bileşikler haline gelir. Katyonlar ve anyonlar arasındaki bağların oluşumuna iyonik bağ denir ve bu bileşiklere iyonik bileşikler denir.