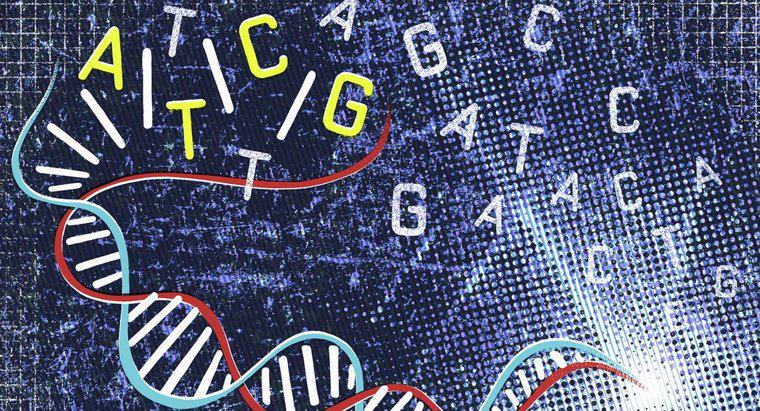
Klorür iyonunun toplamda 18 elektronu vardır. Bu, en iç kabuğunda iki, ikinci kabuğunda sekiz ve üçüncü değer kabuğunda sekiz tane daha içerir. Bu, en dıştaki değer kabuğunda yalnızca yedi elektron bulunan nötr bir klorin atomunda bulunan 17'den bir tanesidir.
Klorür iyonu, doğada karşılaşılan en yaygın klor şeklidir, nötr klor gaza göre çok daha fazladır. Bunun nedeni klorinin muazzam reaktivitesidir. İki klor atomundan oluşan klor gazı, çok toksik ve aşındırıcıdır. Bunun nedeni, klorinin elektronları çekme kabiliyeti veya elektronativitedir; bu elektronları diğer elementlerden çalmasını sağlar. Sadece azot, oksijen ve flor klorun elektronegatifliğini aşıyor.
Azot ve oksijen gazlarının, elektronegatifliklerinin yüksek olmasına rağmen, aşındırıcı olmamalarının nedeni, gaz molekülleri içindeki bağların niteliğidir. Klor gibi azot ve oksijen gazları da ilgili elementlerinin iki atomundan yapılmış moleküllerden oluşur. Bununla birlikte, klorin molekülleri tek bir bağa sahipken, sadece iki elektron paylaşırken, oksijen molekülleri bir çift bağa sahiptir, dört elektron paylaşır ve azot altıyı paylaşan üçlü bir bağa sahiptir. İki atomu birbirine bağlayan bağlar arttıkça, kırılması daha zor olur. Diğer malzemelerle reaksiyona girmesi için, bağın tamamen kırılması gerekir, bu nedenle oksijen ve azot gazları genel olarak eşit veya daha yüksek elektronegatifliğe rağmen klordan daha az reaktifdir.