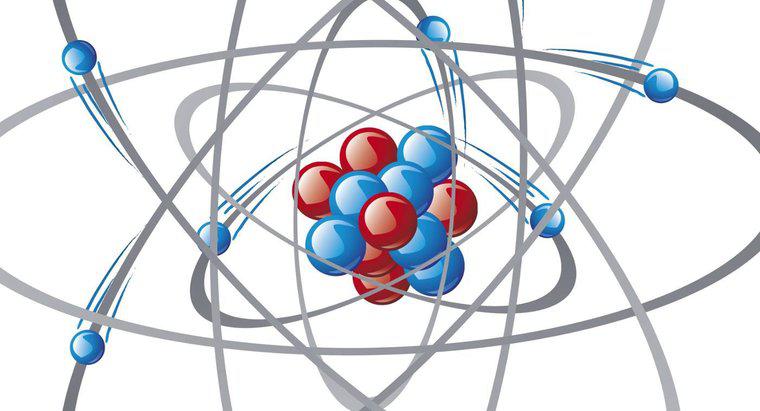
İyonik bir bağda, bir elektron bir atomu diğerine katılmak üzere bırakır, kovalent bir bağ ise iki atom arasında elektron paylaşımı olur. Polar kovalent bağlar, iki atom eşit olmayan sayıda elektron paylaştığında meydana gelir .
Kimyasal bağlar, atomlardaki değerlik elektronları arasındaki etkileşimler nedeniyle oluşur. Değerlik elektronları, bir atomun en dıştaki kabuğunu veya enerji seviyesini işgal eder. Değerlik kabuğu maksimum sayıda elektronla doluysa, kapalı bir kabuktur. Kapalı kabukları olan atomlar atıl olma eğilimindedir ve diğer atomlarla ve moleküllerle reaksiyona girme olasılıkları düşüktür. Açık değerli kabukları olan atomların kapalı bir kabuk oluşturmak için elektronları alması, bağışlaması veya paylaşması muhtemeldir.
İyonik bağlar elektronların bir atomdan diğerine tamamen transferini içerir ve bir donör ve bir alıcı gerektirir. En dış kabukta az sayıda elektron bulunan atomlar, muhtemelen en değerli kabın elektronlarına sahip atomlar genellikle kapalı bir kabuk oluşturmak için daha fazla miktarda alırken, bağış yapma olasılığı yüksektir. İyonik bağ, iki yüklü atom veya iyon oluşumuna yol açar. Bir örnek, tuz veya sodyum klorürdür. Sodyum atomları elektronları kolayca bağışlar, bu da pozitif yük oluşturur. Klor atomları negatif olarak yüklenen bu elektronları kabul eder. Karşıt yüklü iki atom daha sonra bir sodyum klorür molekülü oluşturmak için birbirlerini çekerler.Bazı atomlar kapalı bir kabuk elde etmek için elektronları paylaşır; buna kovalent bağ denir. Örneğin oksijen atomları, kapalı bir kabuk oluşturmak için iki ek elektron gerektirirken, hidrojen atomları bir tane gerektirir. Bir oksijen atomu, elektronlarının ikisini hidrojen atomlarıyla kolayca paylaşır, böylece üç atomun tümü kapalı kabuklara sahiptir. Düzenleme bir su molekülü yaratır. Bununla birlikte, oksijen elektronları hidrojenden daha fazla çeker; bu nedenle, paylaşılan elektronlar, oksijen atomu etrafında, hidrojen atomu etrafından daha fazla zaman harcarlar. Oksijen atomu daha sonra kısmi bir negatif yük taşır ve hidrojen atomlarının her biri kısmi bir pozitif yük taşır. Bu eşitsiz ücrete neden olan bağa kutupsal kovalent bağ denir.