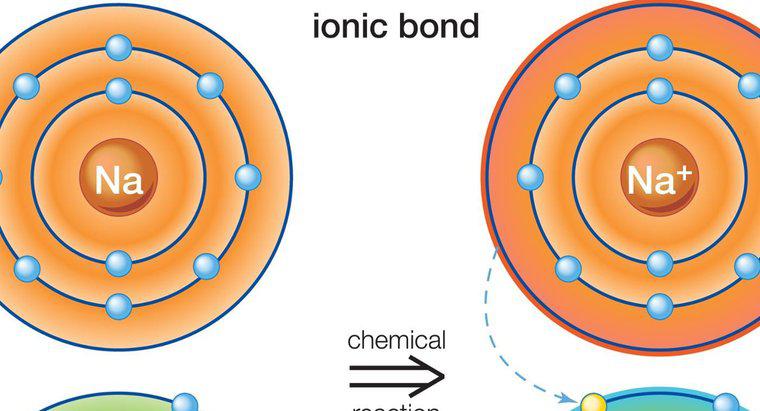
İyonik bileşiklerin sulu çözeltileri, iyi elektrik iletkenleridir, moleküler bileşiklerin çözeltileri değildir. İyonik ve moleküler bileşikler ayrıca suyun kaynama ve erime noktalarını etkiler.
İyonik bileşikler, bu kuralın istisnaları olsa da, suda, moleküler bileşiklerden daha kolay bir şekilde çözünürler. Bir bileşiğin çözünürlüğünü belirlemek için standart olarak su kullanılır, çünkü yüksek polardir ve diğer çözücülerden daha fazla bileşiği çözebilir, bu da evrensel çözücünün ünvanını verir. İyonik bileşikler ayrıldıklarında elektriği iletirler çünkü elektron transferini kolaylaştırırlar. Parçacıkların yükündeki fark, serbest elektronların parçacıktan parçacıklara kolayca sıçramasına izin verir. Moleküller elektronlarını paylaşır ve fazla iletkenliğe izin vermeyen genel bir nötr yüke sahiptir. İyonik bileşikler yüksek erime ve kaynama noktalarına sahipken moleküler bileşikler nispeten düşük erime ve kaynama noktalarına sahiptir. Bu özellikler, içinde bileşikler çözündüğünde suya taşınır. Ayrışmış iyonik bileşikler, erime noktasını yükseltir ve suyun donma noktasını düşürür. Moleküler bileşikler genellikle suda çözülürlerse ters etki yaratırlar.Benzer mesajlar
Diğer ilginç yazılar