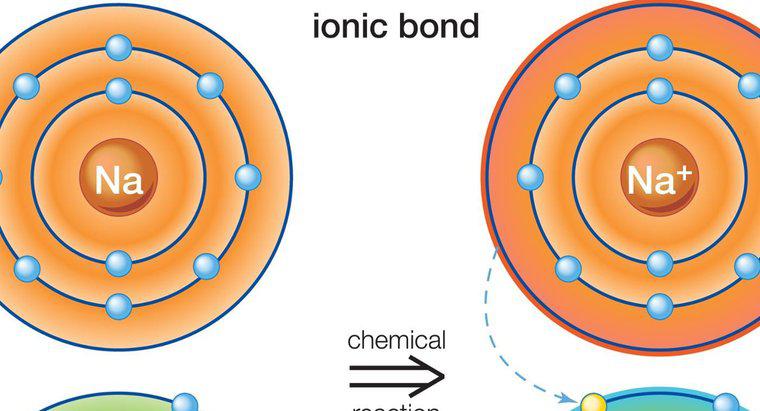
İyonik bileşikler zıt yüklere sahip atomlar ve moleküller içerir. Karşı suçlamaları nedeniyle birbirine bağlanırlar. Örneğin, negatif iyonlu pozitif bir iyon ile bağlanmış iyon bağları. Benzeri yükleri olan atomlar ve moleküller birbirlerini iterler. Pozitif yükü olan moleküller katyonlar ve negatif yükü olan moleküller anyonlar olarak adlandırılır.
İyonik Bileşikler
İyonik bileşikler, ters bir yük ile daha fazla atomu veya molekülü çeken atomların veya moleküllerin bir sonucu olarak oluşur. Kompozisyon, bileşiğin türüne bağlı olarak değişir, ancak tüm iyonik bileşikler nötr bir elektrik yüküne sahip olmalıdır. Bu, eşit oranda anyonik ve katyonik moleküle sahip olmaları gerektiği anlamına gelir.
Moleküler Bileşikler
Kovalent bileşikler olarak da adlandırılan moleküler bileşikler, kovalent bağlar oluşturarak elektronları paylaşır. İyonik bileşikler metalik ve metalik olmayan atomlardan ve moleküllerden oluşurken, kovalent bağlar yalnızca metalik olmayan atomlardan ve moleküllerden oluşabilir. Kovalent bir bileşik, farklı elementlerdeki atomlar moleküller ile birleştirildiğinde oluşur. Bu bağ, atomları molekül içinde bir arada tutan ortak bir çekim yaratan değerlik elektronlarının paylaşılmasını sağlar.
Kovalent bileşiklerin büyüklükleri oldukça değişkendir. Bazıları küçüktür, sadece birkaç elemente sahipken, diğerleri binlerce atom içerebilir. Onları değiş tokuş etmek yerine elektronları paylaştığı için, kovalent bileşikler iyonik bileşiklerden oldukça farklı özelliklere sahiptir. Kovalent bileşikler kolayca yanar, iyonik bileşikler ise yanmaz. İyonik bileşiklerin aksine, suda çözünür değildir. İki molekül tipi arasındaki diğer bir ayrım, kovalent bileşiklerin elektrik iletemediği, ancak iyonik bileşiklerin genel olarak yapabilecekleridir. Oda sıcaklığında, çoğu kovalent bileşik katı olarak görünmek yerine sıvı veya gaz halindedir. Bunun nedeni, kendi moleküllerinin, kristalin içindeki moleküllerden daha kolay bir şekilde ayrılmalarıdır, bu da onlara nispeten düşük bir kaynama noktası verir. Basit moleküler bileşikler aynı isim yapısına sahiptir. Periyodik tabloda, önce soldaki en uzak görünen elemanı isimlendirerek, ardından ikinci adlandırılmış elemana "ide" ekleyerek ve her bir elemandaki atom sayısını belirlemek için önekleri kullanarak bulunurlar. Proteinler ve karbonhidratlar iki moleküler bileşik örneğidir. Diğer moleküler bileşikler arasında metan gazı, azot oksit ve sodyum klorür bulunur.