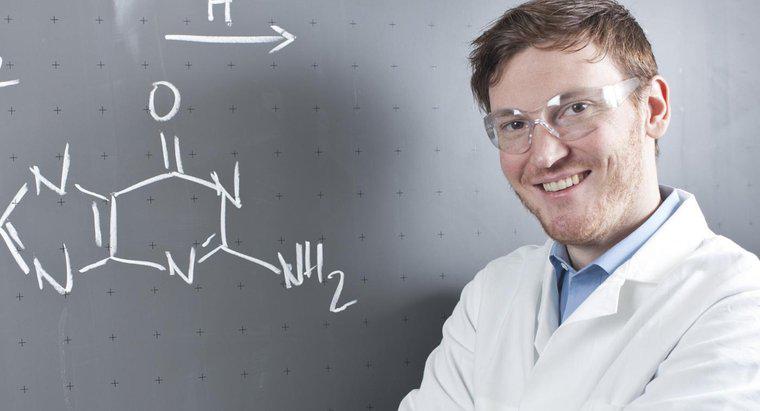
Kimyasal bir denklemde her iki yöne de işaret eden bir ok, reaksiyonun geri dönüşümlü olduğunu ve her iki yöne de devam edebileceğini gösteriyor. Bu, sol taraftaki reaktiflerin aynı zamanda sağdakiler ve tam tersi.
Tersine çevrilebilir bir reaksiyonu iki ayrı kimyasal denklem (her bir yön için bir tane) olarak yazmak yanlıştır, çünkü ürünler her zaman reaksiyona girer ve orijinal reaktiflere geri döner. Her iki reaksiyon aynı anda gerçekleştiğinden, kimyasal sistem dengeye ulaşana kadar bir akış halindedir. Bu, her bir tepken maddenin konsantrasyonunun sabit kaldığı ve zaman içinde net bir değişiklik göstermediği bir nokta olduğu anlamına gelir. Bu, her reaktifin aynı oranda mevcut olduğu anlamına gelmez.
Her bir tepkenin tepkime hızı ve tepkime katsayıları ne kadarının üretileceğini ve ne kadar sürede üretileceğini belirler. Bazı reaksiyonlar daha hızlı olduğundan ve birinden diğerinden daha büyük miktarlarda reaksiyon gerektirdiğinden, sistem dengeye ulaştığında eşit miktarda mevcut değildir. Dinamik denge sistemlerinde, denklemin her iki tarafındaki reaksiyon oranları tamamen aynıdır, bu nedenle reaksiyonlar ve ürünlerin konsantrasyonları her iki reaksiyon da süresiz olarak devam etse bile sabit kalır.