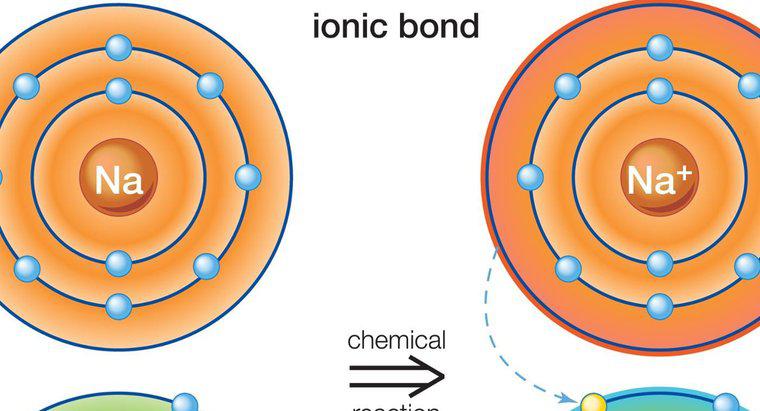
Tam şarjlardan ziyade kısmi yükler arasındaki çekimin bir sonucu olduklarından, hidrojen bağları iyonik veya kovalent bağlardan çok daha zayıf olur. İyonik ve kovalent bağlar, farklı maddelerin atomlarını bir araya getirmek için bir araya getirir. Bileşiklerin molekülleriyken, hidrojen bağları molekülleri birbirine çekmeye meyilli güçlerdir. Hidrojen bağının bir örneği, her bir su molekülü içindeki hidrojen ve oksijen atomları arasındaki çekim kovalent bağlamayı temsil ederken, bireysel su molekülleri arasındaki çekimdir.
Bir moleküldeki pozitif polarize bir hidrojen atomu, başka bir moleküldeki yüksek oranda elektronegatif bir atoma çekildiğinde bir hidrojen bağı oluşur. Su molekülleri örneğinde, bir su molekülündeki negatif yüklü oksijen atomu başka bir su molekülündeki pozitif yüklü hidrojen atomunu çeker. Oksijen atomları, elektronları moleküller içindeki hidrojen atomlarından uzağa çalma eğilimindedir. Bu, bir su molekülü içinde meydana geldiğinde, elektron kaybı, kısmen pozitif yüklü bir hidrojen atomu yaratır; bu, başka bir su molekülündeki negatif yüklü bir oksijen atomuna çekilir.
Su molekülleri arasında oluşan hidrojen bağları birbirine yapışmalarına neden olur. Bu, suya yüksek bir kaynama noktası sıcaklığı verir, çünkü moleküller arası hidrojen bağlarını kırmak için daha yüksek derecede bir ısı enerjisi gerekir. Nükleik asitler ve proteinler gibi yaşamı sürdürmesi gereken birçok organik madde, hidrojen bağları içerir. Her ne kadar bu bağlar, moleküller içindeki atomlar arasında mevcut olan iç iyonik veya kovalent bağlardan daha zayıf olsa da, canlı organizmalar içindeki hidrojen bağlarının biriken gücü oldukça önemlidir ve kararlılığın korunmasında önemli bir rol oynar.