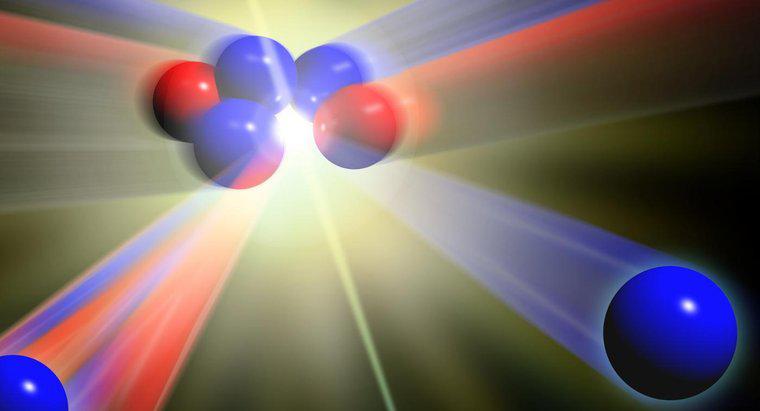
Farklı kütlelere sahip aynı elementin atomlarına izotoplar denir. Farklı sayıda nötron olduğunda farklı kütleler oluşur. Belirli bir öğenin tüm atomları aynı sayıda protona sahiptir.
Bir elemanın farklı izotoplarını tanımlamak için, eleman sembolüne nötronların sayısı yazılır. Örneğin, iki ortak uranyum izotopları U-236 ve U-238 olarak yazılmıştır.
Bir atom tipik olarak proton sayısı ile aynı sayıda nötron ve elektrona sahiptir. Bir atomun farklı sayıda elektronu olduğunda, daha az elektron varsa atomun elektrik yükü pozitif veya ek elektronlar varsa negatif olur. Pozitif veya negatif yüklü atomlara iyon denir. Bir atomun farklı sayıda nötronu olduğunda, nötronların elektrik yükü olmadığından, atomun elektrik yükü etkilenmez. Yine de, izotoplar farklı bir atomik ağırlığa sahiptir.
Periyodik tabloda, her bir eleman için atom ağırlığı veya atom kütlesi verilir. Sayı bir tam sayı değildir, çünkü bir elementin izotoplarının doğal bolluğunu yansıtır. Örneğin, hidrojenin atomik kütlesi 4.003'tür. Kimya hesaplamalarında, atom kütlesi bir elementin bir örneğinin element için doğal izotop aralığını içerdiği varsayımıyla kullanılır.