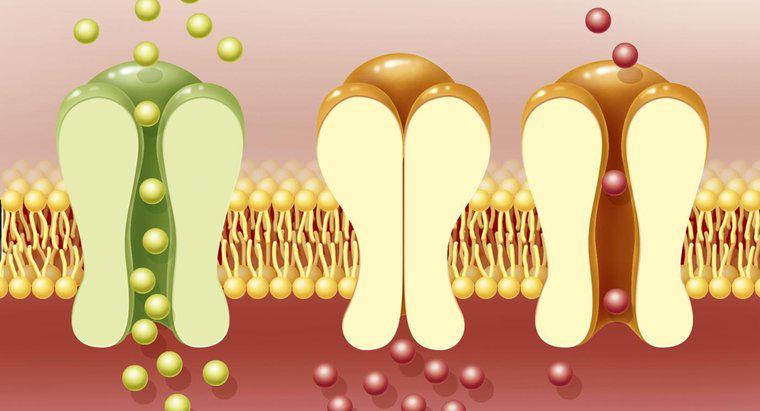
İki temel elektrokimyasal hücre türü, UC Davis'e göre galvanik hücreler ve elektrolitik hücrelerdir. Galvanik hücreler kendiliğinden kimyasal reaksiyona girer ve elektrik enerjisi açığa çıkarırken, elektrolitik hücreler kendiliğinden olmayan enerjiyi çalıştırmak için elektrik tüketir Kimyasal reaksiyonlar Her iki tip de bir anot, bir katot, elektrolit çözeltileri ve bir tuz köprüsü gerektirir.
Galvanik hücreler, şarj edilemeyen piller gibi cihazlar içerir. Bu tür cihazlar, genellikle iki farklı metalden yapılmış olan bir elektrottan diğerine bir elektron akışı oluşturur. Galvanik bir hücrede, elektronlar anottan katoda akar. Bu işlem sırasında anot, metal iyonlarını çevreleyen bir sıvı veya jel çözeltisi olan elektrolit olarak serbest bırakır. Elektronlar katoda aktığında, kendilerini çevreleyen çözelti içindeki metal iyonları tarafından alınır ve iyonlar yüklerini kaybeder ve standart metal atomları haline gelir.
Şarj edilebilir piller, şarj olurken elektrolitik piller ve cihazlara güç verirken UC Davis'e göre galvanik piller gibi davranırlar. Bir elektrolitik hücre, kimyasal bir reaksiyonu kendiliğinden yapacağı ters yönde meydana gelmeye zorlamak için elektrik kullanır. Bu nedenle, şarjlı bir bataryada meydana gelen kimyasal reaksiyon, batarya enerji saldığında meydana gelen reaksiyonun tam tersidir.