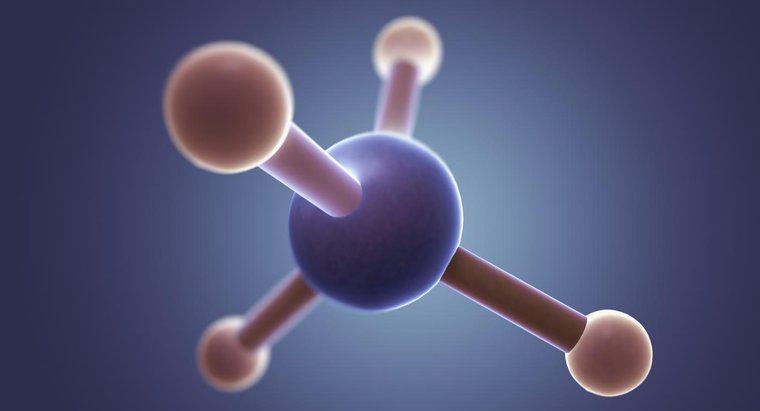
Bir amonyak molekülünün yapısı, bir trigonal piramidal moleküler geometride üç hidrojen atomu ile çevrili bir azot atomundan oluşur. Amonyak, formüllerde NH <3> 3 olarak gösterilir ayrıca amonyak gazı, nitro-sil, Hartshorn'un Ruhu, susuz amonyak, aromatik amonyak ve vaporole olarak da adlandırılır. Moleküler ağırlığı 17.0305'tir.
Amonyak renksiz, keskin kokulu bir gazdır. Hem doğal olarak hem de üretim yoluyla elde edilir. Doğadan canlıların, bakterilerin ve hayvan atıklarının çürümesinden üretilir. Hava, su ve toprakta doğal olarak oluşan hayvanlar ve bitkiler için bir azot kaynağı sağlar.
Üretilen amonyak en çok gübrelerde kullanılır. Diğer imalat kullanımları şunlardır:
- pestisitler
- kağıt hamuru ve kağıt
- patlayıcılar
- sentetik elyaflar
- tuzları koklamak
- temizlik ürünleri
- yakıt hücreleri
- roket yakıtı
- nitrik asit ve siyanür gibi diğer kimyasallar
Amonyak, çeşitli endüstrilerde de kullanılır:
- Metal işleme ve klorlu su arıtma.
- Kauçuk endüstrisi: ham lateksi stabilize etmek için kullanılır.
- Petrol endüstrisi: ekipmanı korur.
- Narenciye tarımı: Mantarları önlemek için depolarda depolanan portakal, limon ve greyfurtlara uygulanır.
Amonyak ayrıca et, balık ve kümes hayvanı işleme tesislerinde soğutucu olarak da kullanılabilir; süt ve dondurma bitkileri; bira imalathaneleri ve şarap imalathaneleri; yiyecek ve içecek işleme tesisleri ve genel soğuk hava deposu depolaması.
ABD Ulusal Tıp Kütüphanesi'ne göre, düşük amonyak seviyelerine maruz kalmak yaygındır ve tesiste amonyak içeren kimyasallar kullanıyorsa, evlerde, gübrelerle yapılan çiftliklerdeki ve işte amonyak kullanımlarını içerir. Amonyak seviyelerinin yükselmesi tehlikeli olabilir, bu da ciğerlerde sıvı birikmesine ve gözler, boğaz ve ciltte yanmaya neden olabilir. Amonyağın yutulması ağız, boğaz ve mideyi yakacak ve akut karın ağrısına neden olabilir. Cilde doğrudan maruz kalmak yanıklara, kabarmaya ve dermatite neden olabilir. Gözlere doğrudan temas, tahrişe veya korneaya, konjonktivite ve geçici veya kalıcı körlüğe zarar verebilir.