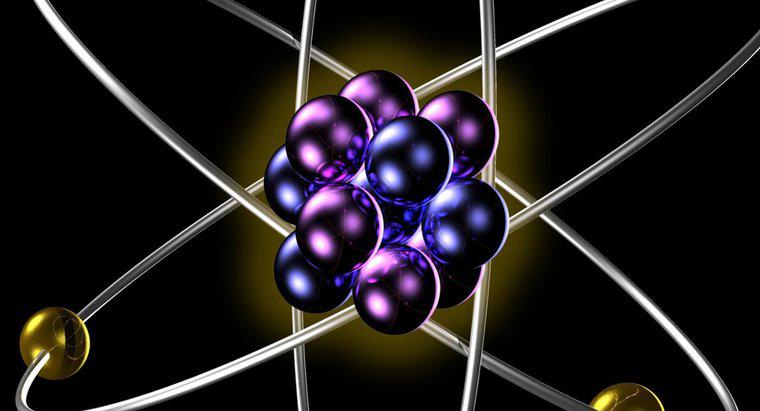
Aynı elementin izotopları, nötr atomik formdayken aynı sayıda proton ve elektron içerir. Farklı izotoplar, çekirdeklerinde farklı sayıda nötron içerir, bu da farklı izotopları için farklı atom ağırlıklarına neden olur. tek bir öğe.
Bir elementin atomlarının çekirdeğindeki protonların sayısı, bu elementin atom kütlesini verir. Atom kütlesi, elementin tüm izotopları için sabittir. Atom kütlesi, atomun çekirdeğinin nötr olması için çekirdeği yörüngesinde bulunması gereken elektron sayısını belirlediği için, bu atom kütlesi elementin kimyasal davranışını belirler, çünkü tüm nükleer olmayan kimya, atomların elektron bulutlarının bir ile etkileşimlerinden kaynaklanır. bir diğeri. Bu, aynı elementin tüm izotoplarının kimyasal reaksiyonlara aynı şekilde katıldığı anlamına gelir.
İzotop davranışındaki bir fark, belirli izotopların çekirdeği, çekirdekteki nötronlara giden proton sayısındaki dengesizlik nedeniyle kararsız olduğunda ortaya çıkar. Atom çekirdeğinin stabil olması için her proton için kabaca bir nötron bulunmalıdır. Nötronların sayısı proton sayısına orantısız şekilde arttıkça, çekirdek kararsız hale gelir ve bu aşırı nötron ağırlığını alfa ve beta parçacıkları ve gama radyasyonu formunda aktarabilir.