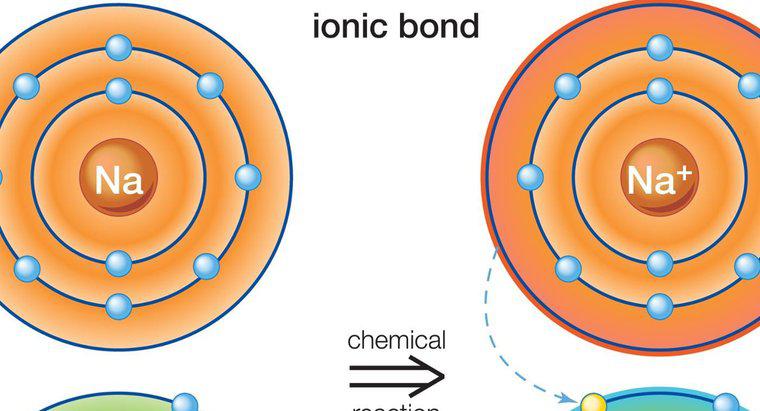
İyonik bileşikler, elektronlar bir atomdan diğerine geçerken oluşur. Kovalent bileşikler, atomlar elektronları paylaştığında oluşur ve iyonik bileşiklerde görüldüğü gibi net elektron kaybı veya elektron kazancı oluşmaz.
İki veya daha fazla farklı kimyasal element birleştiğinde, bir bileşik oluştururlar. Bu atomların nasıl bir araya gelip bağlandıkları elemente ve özelliklerine bağlıdır. Atomları bir arada tutan bağ, olduğu bileşiğin tipini belirler ve bunlar iyonik veya kovalent olabilir.
Bonding Temelleri Atomlar, içerdikleri elektronların sayısıyla sınıflandırılır ve karakterize edilir. Her elemanın, çekirdeğin etrafındaki yörüngelere yerleştirilmiş farklı sayıda elektronu vardır. Dış orbital, değerlik orbital olarak bilinir ve bu elektronlar, bağlama işleminde kullanılanlardır. Her atom kararlı olabilmesi için tam bir dış yörünge elektronuna sahip olmayı amaçlamaktadır. Çoğu atom için, bu dış yörünge sekiz elektron tutar. Oktet kuralı dış yörüngeyi doldurmak için elektronların elektronları kazanması, kaybetmesi veya paylaşması gerekliliğini ifade eder. Atomlar elektronları başka bir elemana kazandıklarında veya bağışladıklarında iyonik bileşikler oluştururlar. Atomlar elektronları başka bir elementle paylaştığında, kovalent bileşikleri oluştururlar.
İyonik Bileşikler
İyonik bileşikler metaller ile metal olmayanlar arasında oluşur. Metaller tipik olarak dış yörüngede pek az değerlik elektronuna sahipken, metal olmayanların birçoğu vardır. Metal bir donör olarak görev yapar ve değerlik elektronlarını metanal olmayan maddeye transfer eder, böylece kararlı bir atom oluşturmak için gereken sekizli kuralını yerine getirir. Bu, pozitif yüklü bir metal atomu ve iyonlar olarak bilinen negatif yüklü bir metal olmayan atom ile sonuçlanır. Ters yükler nedeniyle, iki iyon birbirine tutturulur ve birbirine yakın durur, böylece bir iyonik bileşik oluşur. Bu işlemde birden fazla elektron transfer edilebilir. Yüklenen atomlar serbestçe yüzdüğü için, yalnızca bağışladıkları veya elektronları aldıkları tek bir atomu değil, diğer şarjlara karşı yükü çekerler.İyonik bileşiklerin özellikleri, yüksek erime ve kaynama noktalarına sahip kristal katı olmalarıdır. Erimiş olduklarında elektriği iletirler ve suda çözünürler, ancak polar olmayan sıvıları değil. En yaygın iyonik bileşiklerden biri, sofra tuzu olarak da bilinen sodyum klorürdür (NaCl).
Kovalent Bileşikler
Buna karşılık, kovalent bileşikler tipik olarak metal olmayanlar veya aynı veya benzer elementlerin iki atomu arasında meydana gelir. Periyodik tablodan tespit edilebilecek benzer elektronegatifliklere sahip atomlar birbirlerini çekme ve kovalent bağlar oluşturma eğilimindedir. Değerlik elektronlarını tamamen aktarmak yerine, atomlar sekizli kuralını yerine getirmek için dış elektronları paylaşır. Paylaşılan elektronlar bağlı atomlar arasında ileri geri hareket edebilir. Her iki atom da bu bağ türünde bir elektron kazanmıyor ya da kaybetmiyor, bu nedenle iyon oluşmuyor. Bu nedenle, bileşikteki atomlar, iyonik bileşiklerde görülenler gibi yakındaki diğer atomlara çekici değildir.
Kovalent bileşikler katılar, sıvılar veya gazlar olabilir. Zayıf elektrik iletkenleri olma eğilimindedirler ve düşük erime ve kaynama noktalarına sahiptirler. Polar olmayan sıvılarda çözünür olma eğilimindedirler, fakat suda çözmezler. Bazı yaygın kovalent bileşik örnekleri metan (CH4) ve karbondioksit (CO2) 'dir.